Investigadores de la Fundación Instituto Leloir comprobaron en animales de laboratorio que la molécula TNF-alfa está involucrada en la inflamación que genera el cerebro tras el trasplante de cierto tipo de neuronas derivadas de células madre, terapia que se ensaya para restaurar funciones biológicas alteradas. Además, según publicaron en PLOS One, determinaron in vitro que si se la inhibe aumenta la sobrevida de estas neuronas.
(Agencia CyTA-leloir).- El desarrollo de terapias regenerativas es una de las grandes apuestas de la comunidad biomédica internacional para abordar patologías neurodegenerativas como la enfermedad de Parkinson. En ese camino, el trasplante en el cerebro de cierto tipo de neuronas derivadas de células madre (llamadas precursoras neuronales dopaminérgicas o DA-CM) es considerado una alternativa para reemplazar funcionalmente la pérdida de neuronas producida por la afección degenerativa; de hecho, hay tres ensayos clínicos en marcha en distintos países para estudiar esta estrategia terapéutica. Sin embargo, se estima que apenas el 10% de las células transferidas logra sobrevivir post-trasplante. Ahora, un trabajo de investigadores de la Fundación Instituto Leloir (FIL) podría cambiar este panorama: según publicaron en la revista PLOS One, inhibir una molécula proinflamatoria llamada factor de necrosis tumoral o TNF-alfa aumentaría la sobrevida de las neuronas trasplantadas.
“Todo trasplante cerebral gatilla inflamación y desde hace más de 25 años venimos comprobando que ésta modifica la sobrevida y la función de las neuronas dopaminérgicas”, señaló a la Agencia CyTA-Leloir Fernando Pitossi, jefe del Laboratorio de Terapias Regenerativas y Protectoras del Sistema Nervioso Central de la FIL y uno de los autores del artículo. En el nuevo trabajo, Pitossi y sus colegas concluyeron en estudios in vitro que la inhibición del TNF-alfa aumenta la sobrevida de DA-CM. “Identificar esta molécula es un gran paso para el diseño de una terapia antiinflamatoria complementaria al trasplante celular contra la enfermedad de Parkinson”, añadió el científico.
La enfermedad de Parkinson es un trastorno neurológico progresivo cuyos síntomas motores se producen principalmente por la muerte de las neuronas dopaminérgicas de una zona del cerebro. Los tratamientos actuales no detienen su avance ni permiten reestablecer el funcionamiento de lo que se ha perdido. Por eso, la medicina regenerativa causa mucha expectativa: apuesta al reemplazo, la reparación o regeneración de células, tejidos u órganos de manera de restaurar funciones biológicas alteradas. Lo hace en base al uso de células madre que tienen la capacidad de convertirse en células especializadas.
“Uno de los tipos de células madre que más se utilizan en la actualidad en estos estudios experimentales son las pluripotentes, capaces de diferenciarse en más de 200 tipos celulares diferentes como, por ejemplo, neuronas específicas”, señaló Pitossi, cuyo grupo generó DA-CM humanas y detectó que al trasplantarlas a animales de laboratorio, aun inmunosuprimidos, el cerebro genera no sólo la inflamación sino también el TNF, que puede disminuir su sobrevida. Por eso, la importancia de comprobar qué sucedía al inhibirlo.
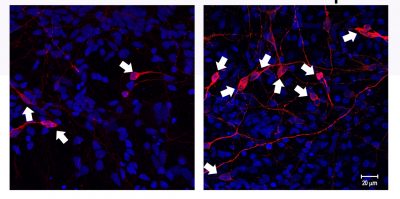
En rojo, neuronas dopaminérgicas humanas (indicadas con flechas) incubadas en un ambiente inflamatorio (Izq.). El mismo experimento luego de inhibir TNF muestra cómo aumenta el número de neuronas (der.).
Según Pitossi, aún queda un paso más de investigación para refinar una posible terapia anti-TNF asociada al trasplante celular, dado que este tipo de moléculas (citoquinas) pueden tener efectos duales sobre las neuronas. “Según su concentración, el contexto y la duración de su expresión, pueden ser tóxicos o proteger a las neuronas”, describió. En el caso del TNF, explicó, la molécula ejerce su acción a través de dos receptores: tipo 1 y tipo 2. “Creemos que el efecto tóxico del TNF es a través del receptor de tipo 1. Por eso, nuestras investigaciones futuras estarán enfocadas a estudiar esta hipótesis y ver si al inhibirlo podemos prevenir la muerte de las neuronas sin alterar ningún efecto benéfico que TNF pudiera estar ejerciendo a través del receptor tipo 2”, destacó.
El primer estudio clínico de terapia celular para Parkinson se realizó hace 35 años y desde entonces se avanzó a paso lento. En la actualidad hay tres ensayos para desarrollar terapias regenerativas que utilizan DA-CM como las que analizó el grupo de Pitossi: uno empezó en 2018 en Japón; otro en 2021 en los Estados Unidos; y otro este año, en Suecia y Gran Bretaña.
Impacto global
La enfermedad de Parkinson es una afección degenerativa del cerebro asociada a síntomas motores (lentitud de movimientos, temblores, rigidez, trastornos de la marcha y desequilibrio) y a una amplia variedad de complicaciones no motoras como deterioro cognitivo, trastornos mentales y trastornos del sueño, entre otras. Al progresar, produce limitaciones en distintos aspectos de la vida cotidiana y con el tiempo da lugar a altas tasas de discapacidad y necesidades de atención.
Según la Organización Mundial de la Salud (OMS), 8,5 millones de personas en el mundo padecen la enfermedad, que afecta sobre todo a los mayores de 65 años. Es la segunda enfermedad neurodegenerativa más frecuente después del mal de Alzheimer. En la Argentina se estima que existen entre 70.000 a 100.000 pacientes afectados.

Fernando Pitossi (pulóver a rayas) con su grupo del Laboratorio de Terapias Regenerativas y Protectoras del Sistema Nervioso Central de la FIL. Shirley Wenker (tercera desde la der.) es la primera autora del artículo publicado en PLOS One.
Estudios recientes de Scott Johnson, especialista estadounidense en economía de la salud, estiman que un 20% de enlentecimiento en la progresión del Parkinson significaría un ahorro para el sistema de salud de Estados Unidos de 60.657 dólares por paciente. “La terapia celular contra la enfermedad de Parkinson supone una sola intervención que apunta a reparar las bases biológicas de la patología. Como queda en evidencia, esa intervención única podría tener efectos beneficiosos no sólo en la salud de los y las pacientes, sino también en el sistema sanitario de los países que adopten ese tipo de tratamiento, una vez que se compruebe que es exitoso”, aseguró Pitossi.
Del artículo publicado en PLOS One también participaron Shirley Wenker, María Isabel Farías, Victoria Gradaschi, Corina García, María Celeste Leal y Carina Ferrari (por la Fundación Instituto Leloir-IIBBA CONICET), en colaboración con Xianmin Zeng, de RxCell (EE.UU.) y Juan Beauquis, del IBYME. Y fue posible gracias al financiamiento otorgado por la Agencia I+D+i, la Fundación René Barón y la International Society of Neurochemistry.