Gonzalo de Prat Gay, investigador del CONICET en el Instituto Leloir, explica el funcionamiento de estructuras denominadas fábricas virales, y cómo éstas están relacionadas a un nuevo paradigma de la biología, las organelas sin membrana. Plantea, además, cómo estos mecanismos representan una oportunidad para un enfoque conceptual novedoso en la búsqueda de antivirales tan necesarios en particular para virus respiratorios emergentes, incluyendo coronavirus, sarampión, dengue, el virus del Ébola y otros.
(Agencia CyTA-Leloir)-. Ciertas estructuras subcelulares conocidas en las últimas décadas como “organelas sin membrana” poseen como característica saliente el ser dinámicas y carecer de una envoltura a diferencia de las organelas tradicionales como las mitocondrias o el núcleo. En la última década se determinó que las mismas son en efecto líquidas y responden a principios químicos y físicos conocidos, denominándose el universo de estas estructuras como condensados biomoleculares.
Así lo asegura el doctor Gonzalo de Prat Gay, jefe del Laboratorio de Estructura-Función e Ingeniería de Proteínas en la Fundación Instituto Leloir e investigador superior del CONICET, quien acaba de publicar junto a un grupo de sus colaboradores y colaboradoras y el laboratorio de la doctora Nora López del Centro de Virología Animal (CEVAN-CONICET) un artículo de revisión sobre el tema en la prestigiosa revista “PLOS Pathogens”.
“Los virus, como huéspedes obligados de las células que infectan, no escapan a las leyes generales de la química celular y utilizan también estas estructuras subcelulares para ejecutar las funciones esenciales para su autoperpetuación”, afirma Prat Gay en una entrevista con Agencia CyTA-Leloir.
Para el investigador, el estudio de los condensados biomoleculares inició una “revolución en la biología” que empezó hace tan solo 12 años y ahora impacta tanto en el conocimiento científico (biología celular y molecular, bioquímica, microbiología, plantas, neurociencias, física de materia blanda y ciencia de materiales) como en aplicaciones en el campo de la biotecnología, la industria farmacéutica, la física y la química.
¿Qué características tienen las organelas sin membrana?
Su formación está guiada fundamentalmente por un principio químico conocido en el mundo de los polímeros como separación de fases líquido-líquido, descripto por la teoría de Flory-Huggins a través del cual las gotas de líquidos se separan según su composición. Presentan propiedades químicas y físicas diferentes como viscosidad y tensión superficial, semejando las gotas de emulsión que observamos cuando agitamos una vinagreta. Este mecanismo emerge como algo generalizado a toda la función biológica y ocurre en todos los organismos vivientes. Estas estructuras líquidas, también conocidas como condensados biomoleculares, casi siempre formadas por proteínas y ácidos nucléicos (ARN y ADN), cumplen un rol fundamental en funciones tales como la respuesta celular a estrés, el encendido o apagado de genes, ciclos metabólicos como la glucólisis, la fijación de dióxido de carbono por las plantas y las sinapsis que comunican a las neuronas.
Así como son fundamentales para la supervivencia de las células, ¿tienen también algún rol en la génesis de enfermedades?
Efectivamente. La condensación biomolecular es una etapa necesaria para la generación de estructuras proteicas tóxicas comunes a las diversas patologías neurodegenerativas, como las enfermedades de Alzheimer o Parkinson, o la esclerosis lateral amiotrófica (ELA). Los componentes protéicos, a menudo objeto de una mutación aberrante, se concentran fuertemente en gotas y éstas van modificando sus propiedades materiales hasta dar lugar a estructuras rígidas y tóxicas. Esta evolución de las propiedades materiales hace que sean de gran interés para la física y atrae al campo biológico diversas disciplinas dentro de esta gran área.
Su artículo de revisión explica como este principio químico gobierna la multiplicación de los virus.
Es importante tener en cuenta que, durante muchos años, se observaron estructuras granulares en células infectadas por un gran número de virus diferentes, y que fueron llamadas de diversas maneras como viroplasmas, sitios de replicación, cuerpos de inclusión o, más recientemente, fábricas virales. En la última década, a la vez que se describía la naturaleza líquida de las organelas sin membrana y sus fundamentos fisicoquímicos, se observó que dichas fábricas virales también son de naturaleza líquida y albergan la expresión de los genes que cada virus necesita para su replicación.
¿Cómo actuarían esos condensados en la replicación viral?
Los componentes virales son producidos utilizando la maquinaria celular e inicialmente se distribuyen homogéneamente en la célula. Estos componentes aumentan gradualmente hasta una concentración crítica a partir del cual, según los principios de la separación de fases de polímeros, se dispara la formación de estos condensados líquidos que constituyen las fábricas virales. En esos compartimentos temporales y dinámicos se lleva a cabo la función de replicación y producción del ARN viral que dará lugar a más proteínas virales, las que a su vez se acumulan y concentran en el condensado líquido, generando un ciclo de retroalimentación positiva. El incremento en la concentración de los componentes a su vez potencia las reacciones a través de otro principio fundamental de la química, la ley de acción de masas”, que establece que las reacciones químicas son incrementadas por la concentración de los reactivos. En todo caso, estas fábricas virales sirven de unidad de montaje de pequeñas estructuras con el genoma y proteínas virales que darán lugar a las nuevas partículas de virus que serán liberadas al medio extracelular, extendiendo el proceso infectivo a otras células.
¿En qué virus se observó este proceso?
La formación de condensados virales ha sido más detalladamente descripta en el virus de la rabia, virus respiratorio sincicial, sarampión, VIH, y el coronavirus SARS-CoV2, pero también en numerosos virus y se cree que es algo general, como explicamos en el artículo.
Si se interfiriera con las fábricas virales ¿se frenaría la multiplicación de los virus?
Exacto. Se podría pensar en el desarrollo de fármacos que impidan la formación de estos condensados líquidos que los virus requieren para multiplicarse. Pero para eso es necesario conocer antes en detalle molecular los factores que regulan la formación de esas estructuras, contando con modelos tanto in vitro como en células para ser utilizados como plataforma de descubrimiento de drogas.
¿Hay laboratorios o empresas involucradas en este nuevo concepto en desarrollo de drogas?
En los últimos dos años se han fundado varios startups biotecnológicos en el hemisferio Norte dedicados a los condensados biomoleculares, los que han tejido alianzas con grandes farmacéuticas, enfocándose principalmente en enfermedades neurodegenerativas por cuestiones de mercado. La aplicación de este abordaje a antivirales está en sus albores y apenas hay algún reporte en la literatura científica. Esto provee una ventana de oportunidad para poder desarrollar investigaciones multidisciplinarias en esta dirección en nuestro país, ya que las capacidades están. Otra área de impacto de los condensados y posibles aplicaciones en desarrollo de fármacos poco explorada es el cáncer.
¿Y su laboratorio?
Esta área de investigación en la que convergen la virología, la biología celular y la biofísica es muy estimulante para nosotros, ya que apuntamos a comprender los procesos bioquímicos fundamentales comunes a muchos virus utilizando como modelo al virus del papiloma humano (VPH), al virus respiratorio sincicial y recientemente al coronavirus SARS-CoV2. Este campo resulta de la convergencia de distintas disciplinas que venimos investigando a lo largo de 30 años, y que ahora ayudan a la comprensión de un fenómeno omnipresente en las ciencias de la vida y de alto impacto en nuevos abordajes al descubrimiento de fármacos en general y antivirales en particular. En este momento poseemos las herramientas para algunos virus, otros son desarrollables, pero no sin la fuerte participación de empresas farmacéuticas. En un escenario no tan inalcanzable, deberíamos poder replicar los éxitos nacionales en tantos frentes tecnológicos frente a la pandemia, como vacunas, dispositivos médicos y diagnóstico, en el área de fármacos antivirales.

El laboratorio de Gonzalo de Prat Gay en el Instituto Leloir realiza estudios para desentrañar los mecanismos de condensación biomolecular en diversos virus, que abren la posibilidad de abordajes novedosos para la búsqueda de compuestos con capacidad antiviral.
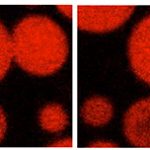
Condensados biomoleculares de proteínas virales. Las gotas contienen proteínas de replicación viral in vitro, una de ellas modificada para emitir un color rojo. La secuencia de imágenes de microscopía de fluorescencia muestra la naturaleza líquida de dichas estructuras a partir de la coalescencia de gotas en función del tiempo.